NEWS CENTER
新闻中心
公司始终坚持,品质至上,精益求精,用户至上,诚实取信,服务尽善尽美
一种基于质谱的单克隆抗体从头测序方法与流程
[ 时间:2024-06-12 阅读:4308次 ]
1.本发明属于生物药表征领域,尤其涉及一种基于质谱的单克隆抗体从头测序方法。
背景技术:
2.近年来,随着越来越多抗体药物的上市,对抗体进行精确的序列测定和结构表征在药物研发过程中变得越来越重要。尤其是抗体的互补决定区即cdr区的序列是抗体发挥活性的重要影响因素。
3.单克隆抗体的从头测序有edman降解法和以质谱为基础的从头测序两种。edman降解法对单克隆抗体的n端进行测序。通常用于测定n端的前30个氨基酸,而得不到单克隆抗体的全长序列。基于质谱的从头测序技术利用一级母离子精确质量数和二级谱图中丰富的多种类碎片离子(a,b,c,x,y,和b/y-h2o/nh3等)进行肽段氨基酸的测序。随后,利用测序得到的高可信度肽段进行序列拼装,同时辅助以同源数据库搜索得到单克隆抗体轻重链的全长序列。目前前沿的从头测序软件都加入了神经网络、深度学习以提高测序的准确度,此外,还支持对翻译后修饰的开放搜索以及对氨基酸可信度的打分等。
4.尽管如此,以质谱为基础的从头测序技术仍旧面临着诸多挑战。例如,对同分异构的亮氨酸和异亮氨酸的区分中,一级质谱和常规解离模式(例如hcd)下的二级质谱中的信息都没有办法辨别两个氨基酸。随着质谱的升级和新的解离模式的应用,研究人员发现采用ethcd对含有i/l的肽段进行碎裂,分别产生29da和43da的质量差,从而达到两种氨基酸的区分。但是,并不是所有的含i/l的肽段都可以得到理想的ethcd谱图,因此,目前结合了三种手段去辨别i/l,分别是同源数据库中i/l的比例、酶切特异性(chymotrypsin和pepsin会在l后进行酶切)和ethcd中谱图信息。
技术实现要素:
5.基于现有技术中存在上述问题,本发明提供一种基于质谱的单克隆抗体从头测序方法,通过高效液相色谱分离和质谱检测得到高质量的单克隆抗体多酶解液质数据,再经过测序软件对二级谱进行从头测序和序列拼装后得到单克隆抗体的氨基酸序列。软件输出的序列经过分子量的验证和手动进一步分析后,单克隆抗体轻重链序列可以达到100%的覆盖率和99.5%以上的氨基酸准确度,从而为未知序列单克隆抗体的精准完整从头测序提供了一种方法,以保证其生物活性。
6.为了实现上述目的,本发明采用的技术方案如下:
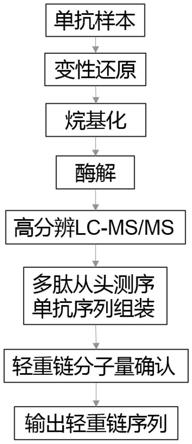
7.一种基于质谱的单克隆抗体从头测序方法,先将单克隆抗体样本依次经过变性还原、烷基化、除盐和酶解步骤制备成多肽,再使用高效液相色谱分离和质谱检测得到高质量的单克隆抗体多酶解液质数据,再经过测序软件对二级谱进行从头测序和序列拼装后得到单克隆抗体的氨基酸序列。
8.根据以上方案,所述的一种基于质谱的单克隆抗体从头测序方法包括以下详细步
骤:
9.步骤s1,取单克隆抗体样本加入6m的盐酸胍缓冲液和1m的二硫苏糖醇(dtt),56℃反应30min进行变性还原;
10.步骤s2,变性还原后的单克隆抗体样本冷却至室温后加入1m的碘乙酰胺(iaa),室温避光反应30min进行烷基化;
11.步骤s3,烷基化之后的单克隆抗体样本使用zeba除盐柱进行除盐;
12.步骤s4,除盐后的单克隆抗体样本加入胰蛋白酶(trypsin)室温酶解10-18小时,调节溶液ph至酸性终止酶解,得多肽样本;
13.步骤s5,取步骤s4中得到的多肽样本进行反相色谱进行肽段分离,再进行质谱检测,得到的原始数据使用商业化从头测序软件peaks ab进行分析,data refine选择correct precursor-mass only;酶解方式选择specified by each sample;固定修饰选择carbamidomethylation(+57.0215da);每个肽允许的最大可变修饰数为3;利用一级母离子精确质量数和二级谱图中丰富的多种类碎片离子进行的肽段的从头测序,继而将肽段序列重新拼装成单克隆抗体序列。
14.根据以上方案,所述的步骤s1中二硫苏糖醇(dtt)的添加量是添加至终浓度为10mm;步骤s2中碘乙酰胺(iaa)的添加量是添加至终浓度为20mm。
15.根据以上方案,所述的步骤s4中还包括步骤s41,测定样本溶液中单克隆抗体的含量,再按质量比单克隆抗体:胰蛋白酶=50:1的比例向单克隆抗体样本溶液中添加胰蛋白酶。
16.根据以上方案,所述的色谱条件如下,色谱柱为c18,流动相a为0.1%fa水溶液,流动相b为0.1%fa乙腈溶液,流速为0.3ml/min,梯度洗脱:
[0017][0018][0019]
柱温为55℃,样品室温度为5℃,上样体积为2μl。
[0020]
根据以上方案,所述的质谱条件如下,喷雾电压为3.8kv,在正离子模式下进行采集,毛细管温度为320℃,s-lens rf水平为50;母离子扫描范围:300-2000m/z;二级质谱选择数据依赖模式(dda)下强度前十的母离子进行解离,归一化碰撞能量(nce)为27%。
[0021]
本发明的有益效果是:
[0022]
1、与现有的数据库搜索鉴定蛋白的方法相比,本发明提供的方法具有发现未知序列新蛋白的优势。
[0023]
2、相比传统edman对n端不超过30个氨基酸进行测序,基于质谱的从头测序技术可以提供单克隆抗体的全长序列。
[0024]
3、分子量的进一步验证和手动对单克隆抗体轻重链序列中氨基酸的二次确认保证了高可信度的序列输出。
附图说明
[0025]
图1是一种基于质谱的单克隆抗体从头测序方法的主要流程图。
[0026]
图2是实施例中经过软件测序装配后得到单抗序列覆盖率图。
[0027]
图3是实施例中单抗的轻重链分子量验证结果图。
[0028]
图4是实施例中从头测序二级谱图。
[0029]
图5是亮氨酸(l)和异亮氨酸(i)的三种区分手段相结合的结果图。
[0030]
附图2-5均为检测分析结果图,为实施例中的结果展示,图中文字均为结果展示,会根据每一次检测分析的结果发生变化,即图中文字与能否重复实施本发明提供的检测方法无关,图中文字不清晰不影响本领域技术人员重复实施本发明提供的检测方法。
具体实施方式
[0031]
下面结合具体实施例和附图对本发明的技术方案进行说明。
[0032]
本实施例中所使用的碘乙酰胺(iaa)、盐酸胍(gdnhcl)均购自sigma-aldrich;二硫苏糖醇(dtt)、三羟甲基氨基甲烷(tris)均购自bio-rad;胰蛋白酶(trypsin)购自promega;除盐柱zeba购自thermo fisher;水(h2o)、乙腈(acn)均购自fisher scientific;甲酸(fa)购自fluka。
[0033]
如图1所示的一种基于质谱的单克隆抗体从头测序方法,先将单克隆抗体样本依次经过变性还原、烷基化、除盐和酶解步骤制备成多肽,再使用高效液相色谱分离和质谱检测得到高质量的单克隆抗体多酶解液质数据,再经过测序软件对二级谱的从头测序和序列拼装后得到单克隆抗体的氨基酸序列,包括以下详细步骤:
[0034]
步骤s1,取100μg单克隆抗体样本加入6m的盐酸胍缓冲液,再加入1m的二硫苏糖醇至二硫苏糖醇的终浓度为10mm,56℃反应30min进行变性还原。
[0035]
步骤s2,变性还原后的单克隆抗体样本冷却至室温后加入1m的碘乙酰胺至碘乙酰胺的终浓度为20mm,室温避光反应30min进行烷基化。
[0036]
步骤s3,烷基化之后的单克隆抗体样本按照供应商提供的操作手册使用zeba除盐柱进行除盐。
[0037]
步骤s4,取除盐后的单克隆抗体样本并测定样本溶液中单克隆抗体的含量,再按质量比单克隆抗体:胰蛋白酶=50:1的比例向单克隆抗体样本溶液中添加胰蛋白酶,室温酶解12小时,调节溶液ph至酸性终止酶解,得到单克隆抗体酶解后的多肽样本,测浓度后分装,暂时不使用的多肽样本采用-80℃保存。
[0038]
步骤s5,取步骤s4中得到的多肽样本使用反相色谱进行肽段分离,再使用高分辨轨道肼质谱仪进行检测,
[0039]
色谱条件如下:色谱柱为c18,流动相a为0.1%fa水溶液,流动相b为0.1%fa乙腈溶液,流速为0.3ml/min,梯度洗脱:
[0040][0041]
柱温为55℃,样品室温度为5℃,上样体积为2μl。
[0042]
质谱条件如下:喷雾电压为3.8kv,在正离子模式下进行采集,毛细管温度为320℃,s-lens rf水平为50;母离子扫描范围:300-2000m/z;二级质谱选择数据依赖模式(dda)下强度前十的母离子进行解离,归一化碰撞能量(nce)为27%。
[0043]
得到的原始数据使用商业化从头测序软件peaks ab进行分析。data refine选择correct precursor-mass only;酶解方式选择specified by each sample;固定修饰选择carbamidomethylation(+57.0215da);每个肽允许的最大可变修饰数为3。单抗的从头测序包括两个方面(图1),一方面是利用一级母离子精确质量数和二级谱图中丰富的多种类碎片离子(a,b,c,x,y,和b/y-h2o/nh3等)进行的肽段的从头测序,一方面是肽段到单抗序列的拼装。经过软件分析后,可以得到单抗轻重链的氨基酸序列及覆盖率和分子量的信息。
[0044]
经过软件测序装配后得到单抗序列覆盖率图(图2)中,序列中的每个氨基酸都得到了可信的测序,其de novo score都大于85%。总体来讲,单抗的轻重链序列覆盖率都达到了100%。
[0045]
在软件测序装配得到单抗轻重链氨基酸序列之后,对单抗的轻重链分子量进行验证。单抗的实验和理论轻重链分子量吻合,该结果进一步表明了基于质谱单抗从头测序技术的准确性(图3)。
[0046]
影响从头测序结果准确性的因素有很多。对于质量非常接近的氨基酸或氨基酸组合,选用质量精度更高的质谱仪进行测序有利于得到更准确的测序结果。此外,部分碎片离子缺失、错误归属b离子和y离子、其他类型碎片离子的干扰、共洗脱肽段混合谱、翻译后修饰(例如n糖基化)和噪音峰等因素都会降低测序结果的准确度。因此,色谱分离的好坏对单抗从头测序也极为重要。图4是从头测序二级谱示例;该条肽段含有31个氨基酸,分子量为3663.7844,-10lgp打分为200.00,电荷z=4;对于长度较长的多电荷肽段,在二级谱解离较好的情况下也能够得到准确测序。
[0047]
目前对于同分异构的亮氨酸(l)和异亮氨酸(i)的区分主要是三种手段相结合的模式(图5)。第一种是同源数据库搜索,根据同源蛋白中此处氨基酸是i或l的概率决定该位点为i或l的可能性;第二种方法是酶切特异性,chymotrypsin和pepsin都可以在l后面发生酶切,这两种酶酶解得到的肽段的c端有更大概率是l而不是i。第三种方法是ethcd,i和l在经过ethcd解离后产生的z离子和w离子质量差分别为29和43da,根据二级谱中对应的质量差即可对i和l进行区分。三种手段联合的模式可以对亮氨酸和异亮氨酸进行精准区分。
[0048]
本发明提供以上实施例仅用以说明而非限制本发明的技术方案,尽管上述实施例对本发明进行了详细说明,本领域的相关技术人员应当理解:可以对本发明进行修改或者同等替换,但不脱离本发明精神和范围的任何修改和局部替换均应涵盖在本发明的权利要求范围内。
技术特征:
1.一种基于质谱的单克隆抗体从头测序方法,其特征在于,先将单克隆抗体样本依次经过变性还原、烷基化、除盐和酶解步骤制备成多肽,再使用高效液相色谱分离和质谱检测得到高质量的单克隆抗体多酶解液质数据,再经过测序软件对二级谱进行从头测序和序列拼装后得到单克隆抗体的氨基酸序列。2.根据权利要求1所述的一种基于质谱的单克隆抗体从头测序方法,其特征在于,其包括以下详细步骤:步骤s1,取单克隆抗体样本加入6m的盐酸胍缓冲液和1m的二硫苏糖醇,56℃反应30min进行变性还原;步骤s2,变性还原后的单克隆抗体样本冷却至室温后加入1m的碘乙酰胺,室温避光反应30min进行烷基化;步骤s3,烷基化之后的单克隆抗体样本使用zeba除盐柱进行除盐;步骤s4,除盐后的单克隆抗体样本加入胰蛋白酶室温酶解10-18小时,调节溶液ph至酸性终止酶解,得多肽样本;步骤s5,取步骤s4中得到的多肽样本使用反相色谱进行肽段分离,再进行质谱检测,得到的原始数据使用商业化从头测序软件peaks ab进行分析,data refine选择correct precursor-mass only;酶解方式选择specified by each sample;固定修饰选择carbamidomethylation(+57.0215da);每个肽允许的最大可变修饰数为3;利用一级母离子精确质量数和二级谱图中丰富的多种类碎片离子进行肽段的从头测序,继而将肽段序列重新拼装成单克隆抗体序列。3.根据权利要求2所述的一种基于质谱的单克隆抗体从头测序方法,其特征在于,所述的步骤s1中二硫苏糖醇的添加量是添加至终浓度为10mm;步骤s2中碘乙酰胺的添加量是添加至终浓度为20mm。4.根据权利要求3所述的一种基于质谱的单克隆抗体从头测序方法,其特征在于,所述的步骤s4中还包括步骤s41,测定样本溶液中单克隆抗体的含量,再按质量比单克隆抗体:胰蛋白酶=50:1的比例向单克隆抗体样本溶液中添加胰蛋白酶。5.根据权利要求3所述的一种基于质谱的单克隆抗体从头测序方法,其特征在于,所述的色谱条件如下,色谱柱为c18,流动相a为0.1%fa水溶液,流动相b为0.1%fa乙腈溶液,流速为0.3ml/min,梯度洗脱:
柱温为55℃,样品室温度为5℃,上样体积为2μl。6.根据权利要求3所述的一种基于质谱的单克隆抗体从头测序方法,其特征在于,所述的质谱条件如下,喷雾电压为3.8kv,在正离子模式下进行采集,毛细管温度为320℃,s-lens rf水平为50;母离子扫描范围:300-2000m/z;二级质谱选择数据依赖模式下强度前十的母离子进行解离,归一化碰撞能量为27%。
技术总结
本发明提供一种基于质谱的单克隆抗体从头测序方法,属于生物药表征领域,通过高效液相色谱分离和质谱检测得到高质量的单克隆抗体多酶解液质数据,再经过测序软件对二级谱进行从头测序和序列拼装后得到单克隆抗体的氨基酸序列,软件输出的序列经过分子量的验证和手动进一步分析后,单克隆抗体轻重链序列可以达到100%的覆盖率和99.5%以上的氨基酸准确度,从而为未知序列单克隆抗体的精准完整从头测序提供了一种方法,以保证其生物活性。以保证其生物活性。以保证其生物活性。
技术研发人员:阮宏强 薛冰冰 李紫艺
受保护的技术使用者:上海中科新生命生物科技有限公司
技术研发日:2021.09.30
技术公布日:2022/1/14